Aufbauův princip je základní metoda, která nám říká, jak jsou elektrony vyplněny v atomovém orbitalu. Podle Aufbauova principu se plnění elektronů v základním stavu atomu řídí základním vzorem. Tento princip nám říká, že elektrony v atomovém orbitalu libovolných atomů jsou zaplňovány vzestupně podle své energie a pro zjištění energie atomového orbitalu se řídí pravidlem n+l.
Princip struktury
V tomto článku se podrobně seznámíme s principem Aufbau, vlastnostmi principu Aufbau, jeho výjimkami a omezeními.
Definice principu struktury
Aufbauův princip říká, že
Elektrony v různých orbitalech jsou zaplňovány v rostoucím pořadí jejich energie, tj. orbital s nejnižší energií bude naplněn jako první a orbital s nejvyšší energií bude naplněn jako poslední.
Slovo „Aufbau“ v němčině znamená „budovat“. Vznik orbitalů znamená naplnění orbitalů elektrony. Uvádí, že elektrony v atomových orbitalech jsou zaplněny vzestupně podle energie atomového orbitalu. A energie atomového orbitalu se vypočítá pomocí pravidla n+l, které říká, zda elektron s vyšším číslem hodnoty n+l má vyšší energii. V pravidle popsaném v předchozím řádku n říká hlavní kvantové číslo a l říká azimutální kvantové číslo.
Pokud mají dva elektrony stejnou hodnotu n+l, pak elektron s menší hodnotou n má menší energii a je naplněn jako první. Pořadí plnění elektronů v atomovém orbitalu je diskutováno níže.
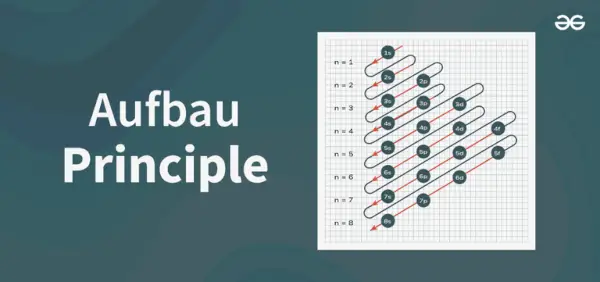
Struktura principiálního diagramu
Aufbauův principiální diagram je diagram, který znázorňuje pořadí plnění elektronů v atomu.
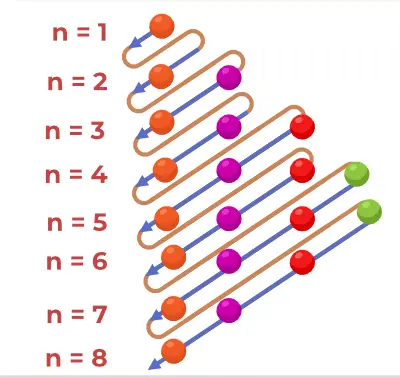
Struktura principiálního diagramu
Struktura základního vzorce
Aufbauův principiální vzorec je vzorec, který říká pořadí, ve kterém jsou elektrony naplněny v atomovém orbitalu. Atomový orbitální vzorec je
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Struktura základní třídy 11
Princip Aufbau je důležitým principem chemie pro studenty ve třídě 11. Tento princip říká, že
Elektrony v atomovém orbitalu atomu jsou vyplněny vzestupně podle energie atomového orbitalu, která se vypočítá pomocí pravidla (n+l).
Kreslení schématu struktury
Diagram Aufbau se kreslí pomocí kroků přidaných níže,
- Najděte počet elektronů, které mají být vyplněny v atomech.
- Víme, že v atomu
- s-orbital pojme maximálně 2 elektrony.
- p-orbital pojme maximálně 6 elektronů.
- d-orbital pojme maximálně 10 elektronů.
- f-orbital pojme maximálně 14 elektronů.
- Doplňte první dva elektrony v 1s orbitalu.
- Pak se řiďte pravidlem n+l a následně podle toho naplňte elektrony.
Hlavní rysy principu struktury
Různé rysy principu Aufbau jsou:
- Energie orbitalu závisí na součtu hodnot hlavního kvantového čísla (n) a azimutálního součtového čísla (I). Toto se nazývá (n + l) pravidlo . Podle tohoto pravidla
- V neutrálním izolovaném atomu platí, že čím nižší je hodnota (n + l) pro orbital, tím nižší je jeho energie. Pokud však dva různé typy orbitalů mají stejnou hodnotu (n + l), pak mají orbitaly s nižší hodnotou n menší energii.
| Typ orbitalu | Hodnota n | Hodnota l weby, jako je bedpage | Hodnota n+l | Relativní energie |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Nejnižší energie |
| 2s | 2 10 1 milionu | 0 | 2+0 = 2 | Vyšší energie než 1s orbitální |
| 2p 3s | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p orbitaly (n=2) mají nižší energii než 3s(n=3) orbital. |
| 3p 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | 3p orbitaly (n=3) mají nižší energii než 4s(n=4) orbitaly. |
| 3d 4p | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d orbitaly (n=3) mají nižší energii než 4p(n=4) orbitaly. |
Z popisu uvedeného v tabulce vyplývá, že energie různých orbitalů rostou s rostoucím počtem hlavního kvantového čísla.
- Tedy pořadí, ve kterém jsou elektrony zaplněny v atomovém orbitalu atom je, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Elektronická konfigurace na principu Aufbau
The elektronická konfigurace použití Aufbauova principu pro několik prvků je diskutováno níže:
Elektronová konfigurace síry
Protonové číslo síry je 16, tj. má 16 elektronů
Nyní pomocí Aufbauova principu je elektronická konfigurace síry zapsána jako,
[S] = 1 s 2 2s 2 2p 6 3s 2 3p 4
Elektronová konfigurace dusíku
Atomové číslo dusíku je 7, to znamená, že má 7 elektronů
Nyní pomocí Aufbauova principu je elektronická konfigurace dusíku zapsána jako,
[N] = 1 s 2 2s 2 2p 3
Výjimky z konstrukčního principu
Existuje několik výjimek z principu Aufbau, kterými jsou chrom a měď. Jejich elektronická konfigurace je
Elektronická konfigurace Chromia
Elektronická konfigurace Chromia podle principu Aufbau by měla být
- Cr(24): [Ar]3d 4 4s 2
Výše uvedená konfigurace však není správná, protože skutečná elektronická konfigurace Chromium(Cr) je,
- Cr(24): [Ar]3d 5 4s 1
Důvodem této elektronické konfigurace je, že polozaplněný d-atomový orbital je stabilnější než orbital vyplněný podle Aufbauova principu.
log4j
Elektronická konfigurace mědi
Elektronická konfigurace mědi podle principu Aufbau by měla být,
- Cu(29): [Ar]3d 9 4s 2
Výše uvedená konfigurace není správná, protože skutečná elektronická konfigurace Copper(Cu) je,
- Cu(29): [Ar]3d 10 4s 1
Důvodem této elektronické konfigurace je, že plně zaplněný d-atomový orbital je stabilnější než orbital vyplněný podle Aufbauova principu.
Přečtěte si více
- Kvantová čísla
- Tvar atomových orbitalů
- Atomová struktura
Princip struktury – FAQ
Co je Aufbauův princip v chemii?
Aufbauův princip v chemii je základní princip, který se používá k vyplnění elektronů v atomových orbitalech jakéhokoli atomu. Tato věta nám říká, v jakém pořadí jsou elektrony zaplněny v atomovém orbitalu.
Kdo dal Aufbauův princip?
Aufbauův princip byl dán slavným dánským fyzikem Nielsem Bohrem v roce 1920.
Co je Pauliho princip vyloučení?
Pauliho vylučovací princip říká, že v atomu žádné dva elektrony nemají všechna čtyři kvantová čísla t on stejný. Alespoň jedno z kvantových čísel se liší pro všechny elektrony v atomu.
Co je pravidlo n+l?
Pravidlo n+l je pravidlo, které říká, že energie orbitalu závisí na součtu hlavního kvantového čísla (n) a azimutálního kvantového čísla (l). toto pravidlo se nazývá pravidlo (n+l).
Jaké jsou výjimky ze zásady Aufbau?
Výjimkou z principu Aufbau jsou
- Elektronická konfigurace Chromium Cr[24]
- Elektronická konfigurace mědi Cu[29]
