Atomové orbitaly , což jsou matematické funkce, popisují vlnové chování elektronů (nebo elektronových párů) v atomu. Atomové orbitaly mají různé tvary podle svého typu. Různé tvary atomových orbitalů popisují, že existuje buď nejvyšší nebo nulová pravděpodobnost nalezení elektronu kolem jádra v některých směrech. Existují čtyři typy orbitalů, z nichž každý má jiný tvar a je reprezentován písmeny s, p, d a f. Orbitaly s a p se berou v úvahu, protože jsou nejhojnější v chemické a biologické chemii. An s-orbitální má uprostřed kulovité jádro, a p-orbitální je ve tvaru činky a čtyři z pěti d orbitaly jsou ve tvaru čtyřlístku. Pátý orbital d je tvarován jako dlouhá činka s koblihou uprostřed. Orbitaly atomu jsou organizovány do vrstev nebo elektronových obalů.
Co jsou atomové orbitaly?
Atomové orbitaly jsou trojrozměrný prostor blízko jádra atomu, kde je možnost objevení elektronu maximální.
Atom, podle kvantového atomového modelu, může mít nekonečný počet orbitalů. Tyto orbitaly lze klasifikovat na základě jejich velikosti, tvaru nebo orientace. Užší orbital znamená, že je větší pravděpodobnost zachycení elektronu blízko jádra. Orbitální vlnová funkce je často známá jako matematická funkce, která se používá k vyjádření souřadnic elektronu. Pravděpodobnost lokalizace elektronu je reprezentována druhou mocninou orbitální vlnové funkce. Tato vlnová funkce také pomáhá při vytváření diagramů hraničních ploch.
Funkce orbitální vlny
The kvantový atomový model předpovídá, že atom může mít obrovské množství orbitalů. Tyto orbitaly lze seskupit podle jejich velikosti, geometrie nebo sklonu. Snížená velikost orbity zvyšuje pravděpodobnost získání elektronu blízko jádra. Matematická funkce používaná k reprezentaci souřadnic elektronu se nazývá orbitální vlnová funkce . Pravděpodobnost objevení elektronu je reprezentována druhou mocninou orbitální vlnové funkce.
Tuto vlnovou funkci můžeme také použít k vytvoření diagramů hraničních ploch. Tvar orbitalů lépe pochopíme pomocí diagramů hraničních ploch konstantní hustoty pravděpodobnosti pro různé orbitaly.
ins klíč
Tvary atomových orbitalů
Tvary atomových orbitalů se liší. To znamená, že rozdělení pravděpodobnosti jimi popisovaných elektronů obklopujících jádro je různé. Skutečnost, že elektrony v různých orbitalech jsou pravděpodobně umístěny v různých oblastech kolem mateřského jádra, a proto zažívají jeho přitažlivost s různou silou, je jedním z důvodů, proč se energie orbitalů pohybuje. Je s podivem, že všechny orbitaly v daném obalu atomu vodíku mají stejnou energii a přitom mají různé formy. To je způsobeno eliminací různých příspěvků souvisejících s energií.
Ale jakmile je tam druhý elektron, degenerace zmizí.
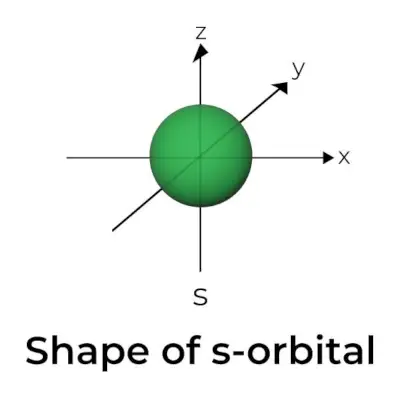
Tvar s-orbitalu
- Diagram orbitálního hraničního povrchu s připomíná kouli s jádrem ve svém středu, kterou lze zobrazit ve dvou rozměrech jako kruh.
- s-orbitaly jsou sféricky symetrické, což znamená, že pravděpodobnost nalezení elektronu v dané vzdálenosti je ve všech směrech stejná.
- Podobně se ukazuje, že velikost orbitalu s roste s rostoucí hodnotou primárního kvantového čísla (n); tedy 4s> 3s> 2s> 1s.
- Uzlový bod je místo, kde není šance elektron lokalizovat. Uzly jsou rozděleny do dvou typů: radiální uzly a úhlové uzly. Vzdálenost od jádra je vypočítána pomocí radiálních uzlů, zatímco orientace je určena úhlovými uzly.
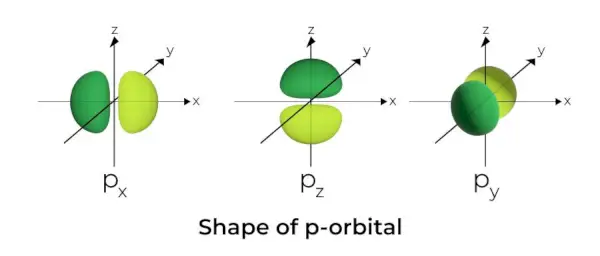
Tvar p-orbitalu
- Orbitaly p jsou tvořeny jako činky.
- Orbitální uzel p se nachází ve středu jádra.
- Kvůli přítomnosti tří orbitalů může orbital p obsadit maximálně šest elektronů.
- Každý p orbital se skládá ze dvou částí známých jako laloky, které jsou umístěny na obou stranách roviny, která prochází přes jádro.
- Každý p orbital má části známé jako laloky na obou stranách roviny, která prochází přes jádro. V rovině, kde se oba laloky protínají, je pravděpodobnost nalezení elektronu nulová.
- Tyto tři orbitaly jsou známé jako degenerované orbitaly, protože mají stejnou velikost, tvar a energii.
- Jediný rozdíl mezi orbitaly je orientace laloků. Protože jsou laloky orientovány podél osy x, y nebo z, dostaly názvy 2px, 2pya 2pz. Pro výpočet počtu uzlů se používá vzorec n –2.
- Podobně jako u orbitalů s roste velikost a energie orbitalů p s rostoucím primárním kvantovým číslem (4p> 3p> 2p).
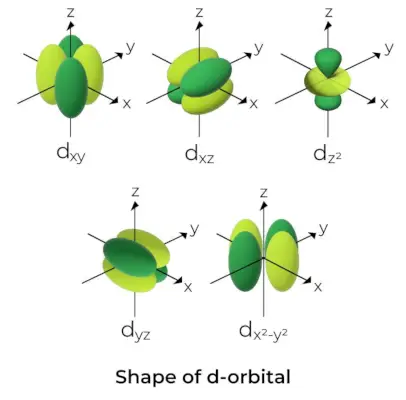
Tvar d-Orbital
- Pro d orbitaly je magnetické orbitální kvantové číslo udáno jako (-2,-1,0, 1,2). V důsledku toho můžeme tvrdit, že existuje pět d-orbitalů.
- Tyto orbitaly jsou označeny symboly dxy, dyz, dxz, dX2-a2a dS2.
- Formy prvních čtyř d orbitalů jsou si navzájem podobné, což se liší od dS2orbital, ale energie všech pěti d orbitalů je stejná.
Tvar f-Orbitalu
- Forma orbitalu f je rozptýlená. Protože hodnota l=3 pro orbital f, minimální hodnota primárního kvantového čísla n je 4.
- Ekvivalentní hodnoty v ml pro orbital f jsou (-3,–2, –1, 0, +1, +2, +3).
- Výsledkem je, že pro l = 3 existuje sedm orbitalů f.

vlk nebo liška
Degenerované orbitaly
Degenerované orbitaly jsou ty se stejnou energií. Tyto orbitaly jsou odlišné (mohou být orientovány odlišně v prostoru kolem atomové jádro ), přesto mají stejnou energii. V přítomnosti vnějšího pole není degenerace p orbitalu ovlivněna; avšak degeneraci orbitalů fad lze rozbít aplikací vnějšího pole na systém (buď elektrického nebo magnetického pole).
Jen málo orbitalů bude mít vyšší energii, zatímco jiné budou mít energii nižší. Degenerace již v systému nebude existovat. Například orbitaly d se skládají z pěti degenerovaných orbitalů, které mají všechny stejnou energii.
Přečtěte si více:
- Molekulární orbitální teorie
- Vyplnění orbitalu v atomu
- Hybridizace
Časté otázky o tvarech atomových orbitalů
Otázka 1: Jak fungují orbitaly?
neměnný seznam
Odpovědět:
Atomový orbital je matematický výraz, který vyjadřuje vlnové chování jednoho elektronu nebo páru elektronů v atomu v atomové teorii a kvantové mechanice. Každý orbital zabere maximálně dva elektrony, každý s vlastním množstvím rotace.
Otázka 2: Co je uzlová rovina?
Odpovědět:
Rovina, kde je pravděpodobnost nalezení elektronu zanedbatelná nebo nulová, se nazývá uzlová rovina.
runas v powershell
Otázka 3: Kolik orbitalů existuje?
Odpovědět:
Protože podúroveň s má pouze jeden orbital, mohou být přítomny pouze dva elektrony. Protože podúroveň p obsahuje tři orbitaly, může být přítomno maximálně šest elektronů. Protože podúroveň d obsahuje 5 orbitalů, může být přítomno maximálně 10 elektronů. A každá ze čtyř podúrovní má sedm orbitalů, které mohou pojmout maximálně 14 elektronů.
Otázka 4: Které orbitaly mají nejvyšší energii?
Odpovědět:
řetězec formátu java
Nejvíce energie má orbitální 1s. Energie elektronu je množství energie potřebné k tomu, aby se dostal z elektrické bubliny atomu.
Otázka 5: Jaký je rozdíl mezi pláštěm a orbitalem?
Odpovědět:
V atomu je obal sbírkou dílčích obalů stejné teorie kvantových čísel, n. Orbitaly mají každý dva elektrony a elektrony ve stejném orbitalu mají stejnou definici velikosti, velikosti momentu hybnosti a magnetického kvantového čísla.
Otázka 6: Co je to vazba sigma a pi?
Odpovědět:
Atomové orbitální překrytí vytváří sigma a pí vazby. Sigma vazby jsou vytvořeny překrýváním atomových orbitálních laloků, zatímco Pi vazby jsou generovány, když jeden atomový orbitální lalok překrývá jiný.
