Báze je chemická sloučenina, která se skládá z OH–ionty a přijímá protony. Báze v chemii jsou ty sloučeniny, které se zbarví do červena lakmusově modrého a když reagují s kyselinou, neutralizují reakci za vzniku soli a vody. Hodnota pH báze je vyšší než 7. Báze jsou hořké chuti a kluzké na dotek. Zásady, které jsou rozpustné ve vodě, se nazývají zásady. Příklady bází jsou oxidy kovů, hydroxidy kovů atd. Mýdlo je příkladem báze, kterou používáme v každodenním životě. V tomto článku se podrobně seznámíme s definicí, vlastnostmi a chemickými reakcemi bází.

Základní definice
Báze je definována jako chemická sloučenina, jejíž hodnota pH je vyšší než 7, přijímá proton, neutralizuje kyselinu a mění červený lakmus na modrý. Obecně osvobozují OH–ion na disociaci. Příklady zahrnují NaOH, NaHCO3,atd. Níže jsou uvedeny některé obecné funkce zobrazené základnou:
- Mají hořkou chuť
- Jsou kluzké na dotek
- Zbarví se do červeného lakmusově modrého
- Osvobozují OH–ion při rozpuštění ve vodě
- Vedou elektrický proud ve formě roztoku
Báze jsou jednou z nejdůležitějších chemických sloučenin, které se používají v každodenním životě. Báze se používají jako antacida ke kontrole kyselosti a v zubní pastě k neutralizaci bakteriálního působení, které produkuje kyselinu v našich ústech a zabraňuje degradaci skloviny a dutiny. Používají se také jako prášek do pečiva, jedlá soda a prací prášek.
Lewisova základna
Lewisovy báze jsou sloučeniny, které mají elektronový pár a mohou jej darovat sloučeninám, které nemají elektronové páry. Lewisovy báze jsou nukleofilní povahy, to znamená, že milují jádra, což znamená, že svými elektronovými páry napadnou kladně nabité centrum. Příklady Lewisovy báze zahrnují amoniak, protože v amoniaku (NH3) střední atom dusíku má 5 elektronů, z nichž 3 se použijí k vytvoření vazeb se 3 atomy vodíku a jeden pár elektronů zůstane s atomem N, čímž vznikne NH3základna Lewis.
Základna Arrhenius
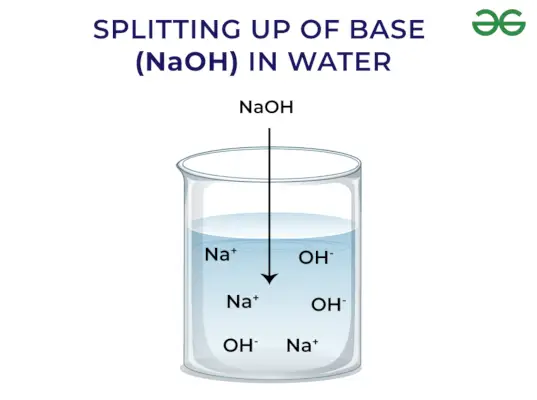
Podle Arrheniovy koncepce jsou báze sloučeniny, které při rozpuštění ve vodě uvolňují hydroxidové ionty a zvyšují koncentraci hydroxylových iontů ve vodném roztoku. Například, když se KOH rozpustí ve vodě, vznikne OH–iontu a tím zvýšit koncentraci OH–ve vodě.
Základna Bronsted
Bronsted Concept of Base je pokročilá verze Arrhenius Concept, která uvádí, že báze jsou sloučeniny, které přijímají H+ion nebo proton za vzniku jejich konjugované kyseliny. Například Cl–je základ, který přijímá H+za vzniku HCl jako jeho konjugované kyseliny.
Typy základen
Báze lze klasifikovat na základě kyselosti, koncentrace a ionizační schopnosti. Klasifikace je uvedena níže
Typy zásad na základě kyselosti
Acidita báze odkazuje na počet nahraditelných hydroxylových skupin přítomných v jedné molekule báze. Podle kyselosti se zásady dělí do tří kategorií:
- Monokyselinová báze
- Diacidická báze
- Triacidická báze
Monokyselinové: Monokyselé báze jsou ty, které obsahují pouze jeden nahraditelný hydroxylový iont a interagují pouze s jedním vodíkovým iontem. Mezi monokyselé báze patří NaOH, KOH a další.
Diacidický: Diacidická báze je báze se dvěma vyměnitelnými hydroxylovými ionty, které interagují se dvěma vodíkovými ionty. Ca(OH)2, Mg(OH)2a další dikyselé báze jsou příklady.
Triacidní: Triacidická báze je typ báze, která obsahuje tři vyměnitelné hydroxylové ionty a tři vodíkové ionty. Mezi triacidické báze patří Al(OH)3, Fe(OH)3, a další.
Typy bází na základě jejich koncentrace ve vodném roztoku
Koncentrace se týká množství báze přítomné ve vodném roztoku. Na základě jejich koncentrace ve vodném roztoku se báze dělí do dvou kategorií:
- Koncentrovaná báze
- Zředěná báze
Koncentrovaná báze: Koncentrované báze jsou takové, ve kterých je množství báze velké ve srovnání s rozpouštědlem. Například koncentrovaný roztok NaOH.
linuxový příkaz make
Zředěná báze: Tyto typy bází mají ve svém vodném roztoku nižší koncentraci báze. Ředění je proces snižování procenta rozpuštěné látky přidáním většího množství rozpouštědla. Například zředit NaOH, zředit KOH a tak dále.
Typy bází podle stupně ionizace
Stupeň ionizace se týká schopnosti chemické sloučeniny uvolnit svůj iont, když se rozpustí ve vodě. V případě báze se stupeň ionizace týká schopnosti báze uvolňovat OH–ionty, když jsou rozpuštěny ve vodě. Na základě stupně ionizace jsou báze rozděleny do dvou typů:
- Silná základna
- Slabá základna
Silná základna: Silné báze jsou takové báze, které se po rozpuštění ve vodě úplně disociují a uvolňují OH-ionty. Některé příklady silných bází zahrnují NaOH, KOH atd.
Slabá základna: Báze, které nepodléhají úplné disociaci a uvolňují pouze zlomek OH-iontu, se nazývají slabá báze. Příklady slabých bází zahrnují Al(OH)3,Cu(OH)2,atd.
Další informace Silné a slabé základy
Vlastnosti bází
Protože víme, že báze jsou chemické sloučeniny, které mají OH- ionty, zbarvují se do červena lakmusově modrého atd. V této části se seznámíme s fyzikálními a chemickými vlastnostmi bází spolu s několika stručnými znalostmi o jejich obecných vlastnostech.
Obecné vlastnosti báze
Obecné vlastnosti bází jsou uvedeny níže:
- Hydroxidový iont (OH–) se uvolňuje do vody zásadami. Čím silnější je báze, tím více iontů se uvolňuje.
- Zásady reagují s kyselinou za vzniku soli Kyseliny reagují se zásadami. Tato reakce báze s kyselinou se nazývá neutralizační reakce.
- Báze se barví z červeného lakmusu do modra.
- Struktura proteinu může být změněna bázemi. Báze mají tuto kvalitu, díky čemuž se cítí hladce. Mýdlo je základ, který po namočení neuvěřitelně klouže po pokožce. Kvůli své schopnosti modifikovat strukturu proteinů jsou některé silné báze extrémně nebezpečné.
Fyzikální vlastnosti bází
Základy chuti Hořce: Základy jsou hořké chuti. Pro jeho hořkost máme jen málo zásadotvorných potravin. Existuje jen několik zásaditých potravinářských materiálů. Zásady je třeba ochutnávat opatrněji než kyseliny.
Základny jsou na dotek kluzké: Při dotyku Báze kloužou. Například mýdlo.
Báze uvolňují OH – Ion: Když jsou báze rozpuštěny ve vodě, uvolňují hydroxylové ionty (OH–). V závislosti na schopnosti uvolňovat hydroxylové ionty jsou klasifikovány jako silné a slabé.
Báze neutralizuje kyseliny: Když Báze reagují s kyselinami, vzájemně se neutralizují a produkují sůl a vodu. Tato reakce se nazývá Neutralizační reakce . Řekněme, že máme kyselinu HY a zásadu „XOH“, pak vytvořená sůl bude „XY“. Rovnice pro tuto reakci může být dána jako HY + XOH → HOH + XY.
Základy denaturačního proteinu: Denaturace proteinu znamená zničení stability a struktury proteinu. To způsobuje, že použití zásady je pro člověka škodlivé, protože lidská kůže a vlasy jsou tvořeny bílkovinami a když se použijí silné alkálie, jako je hydroxid sodný nebo draselný, nazývaný také jako louh, mají škodlivý dopad na lidskou pokožku.
Základy změní červený lakmus na modrý: Když se báze dostanou do kontaktu s červeným lakmusem, změní barvu na modrou. Je však třeba poznamenat, že žádnou takovou změnu nelze pozorovat, když se pokusíme reagovat na suchou bázi s červeným lakmusovým papírkem. Lakmusový papírek je jednou z nejstarších metod testování základny. Existují však i jiné indikátory, jako je fenolftalein
Základny vedou elektřinu: Když jsou báze ve formě roztoku, mají mobilní OH-ionty, a proto mohou vést elektřinu.
Chemické vlastnosti bází
- Reakce báze s kovy: Když alkálie (báze) reaguje s kovem, vzniká sůl a plynný vodík.
Alkálie + kov → sůl + vodík
Příklady:
- Při interakci hydroxidu sodného s kovovým hliníkem vzniká hlinitan sodný a plynný vodík.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Když hydroxid sodný interaguje s kovovým zinkem, vytváří plynný vodík a zinek sodný.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reakce nekovových oxidů s bází: Sůl a voda se tvoří, když nekovové oxidy reagují s bází.
Nekovový oxid + Báze → Sůl + Voda
Když hydroxid vápenatý, báze reaguje s oxidem uhličitým, pak se vyrábí uhličitan vápenatý a voda.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 Ó
- Reakce alkálií/bází s amonnými solemi: Amoniak vzniká, když alkálie reagují s amonnými solemi.
Alkálie + amonná sůl → sůl + voda + amoniak
Když hydroxid vápenatý reaguje s chloridem amonným, vzniká chlorid vápenatý voda a amoniak.
Ca(OH) 2 + NH 4 Cl -> CaCl 2 + H 2 O + NH 3
Příklady bází
Základy jsou obecně oxid kovů, hydroxid kovů, hydrogenuhličitan kovů, uhličitany kovů atd. Podívejme se na některé příklady základů s jejich aplikací v tabulkové formě:
| Základny | Aplikace |
|---|---|
| Hydroxid draselný KOH | Používá se v alkalických bateriích menu nastavení pro android |
| Hydroxid sodný NaOH | Používá se při výrobě mýdla a pracích prostředků |
| Hydroxid hořečnatý Mg(OH) 2 | Používá se jako antacida |
| Bikarbonát sodný NaHCO 3 | Používá se jako jedlá soda |
| Uhličitan sodný Již 2 CO 3 | Používá se jako prací soda |
| Amoniak NH 3 | Používá se při výrobě čisticích a farmaceutických produktů počítačové sítě |
| Hydroxid vápenatý Ca(OH) 2 | Používá se při praní bílé barvy |
Použití bází
Existují různé případy použití báze, některé z nich jsou:
- Hydroxid sodný se používá při výrobě mýdla a papíru. Hydroxid sodný (NaOH) se také používá při výrobě umělého hedvábí.
- Bělicí prášek je vyroben z Ca(OH)2, běžně známý jako hašené vápno nebo hydroxid vápenatý.
- Hydroxid vápenatý se používá k vytváření suchých směsí pro malování a zdobení.
- Hydroxid hořečnatý, lidově známý jako magnéziové mléko, je laxativum, které se široce používá. Používá se také jako antacidum, protože snižuje nadměrnou kyselost v lidském žaludku.
- V laboratořích je hydroxid amonný kritickým činidlem.
- Hašené vápno lze použít k neutralizaci přebytečné kyselosti v půdě.
Přečtěte si více
- Kyselina, báze a sůl
- Síla kyseliny
- Ionizace kyseliny a zásady
Často kladené otázky o základech v chemii
1. Co jsou báze?
- Základní sloučeniny mají hořkou příchuť.
- Textura většiny bází je mýdlová.
- Při testování na lakmusovém papíru ve většině případů přemění červený lakmusový papír na modrý lakmusový papír.
- V roztoku základní sloučeniny také vedou elektřinu.
- Když jsou základní sloučeniny rozpuštěny ve vodě, uvolňují se OH- ionty.
2. Jaké jsou funkce bází?
Doma používáme báze jako čisticí prostředky a antacida. Mýdla, louh (který se používá v čisticích prostředcích na trouby), magnéziové mléko a Tums jsou příklady oblíbených domácích základů. Každý z nich má pH vyšší než sedm, může spotřebovávat volný vodík a neutralizovat kyseliny.
3. Jaký je nejdůležitější rozdíl mezi kyselinou a zásadou?
Kyseliny a zásady jsou dva typy korozivních chemikálií. Kyselé materiály mají hodnotu pH mezi 0 a 7, zatímco zásady mají hodnotu pH mezi 7 a 14. Kyseliny jsou iontové chemikálie, které se rozkládají ve vodě za vzniku vodíkového iontu (H+), zatímco báze disociuje za vzniku OH- iontu.
4. Jaké jsou fyzikální vlastnosti bází?
- Mají hořkou chuť.
- Jejich vodné roztoky mají mýdlovou kvalitu.
- Mění barvu lakmusového papírku z červené na modrou.
- Jejich vodné roztoky jsou elektricky vodivé.
- S uvolňováním plynného vodíku reagují báze s kovy za vzniku soli.
5. Co se stane, když hydroxid vápenatý reaguje s chloridem amonným?
Když hydroxid vápenatý reaguje s chloridem amonným, vzniká chlorid vápenatý voda a amoniak.
Ca(OH) 2 + NH 4 Cl -> CaCl 2 + H 2 O + NH 3
6. Co se stane, když hydroxid sodný reaguje s kovovým zinkem?
Když hydroxid sodný interaguje s kovovým zinkem, vytváří plynný vodík a zinek sodný.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Co je Lewis Base?
Lewisovy báze jsou sloučeniny, které poskytují elektronově deficitní sloučenině pár elektronů. Příklad zahrnuje NH3.
8. Z čeho jsou základny vyrobeny?
Báze obecně sestávají z OH–ion. Kromě těchto oxidů kovů jsou bázemi také uhličitany a hydrogenuhličitany.
9. Co jsou alkálie?
Zásady, které jsou rozpustné ve vodě, se nazývají zásady. Příkladem je hydroxid sodný NaOH.
10. Co je silná a slabá báze?
Báze, které úplně disociují za vzniku OH–ionty při rozpuštění ve vodě se nazývají silná báze. Příklady zahrnují NaOH. Slabé báze jsou ty, které se zcela nedisociují, aby uvolnily OH–iont se nazývá slabá báze. Příklady slabých bází zahrnují hydroxid amonný.
