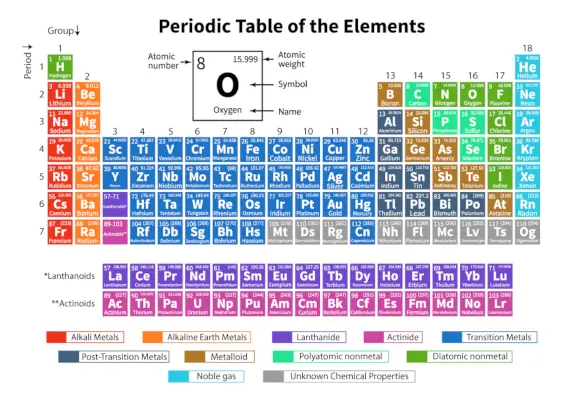
The Periodická tabulka prvků je systematické uspořádání 118 známých chemických prvků. Tyto chemické prvky jsou organizovány v pořadí podle rostoucího atomového čísla. Vodorovné řádky zleva doprava se nazývají tečky, zatímco svislé sloupce shora dolů se v periodické tabulce nazývají skupiny.
Obsah
- Co je periodická tabulka?
- Seznam prvků periodické tabulky
- Důležité pojmy v periodické tabulce
- Klasifikace prvků v periodické tabulce
- Mendělejevova periodická tabulka
- Časté dotazy k periodické tabulce prvků
Co je periodická tabulka?
Periodická tabulka je tabulkové znázornění, ve kterém jsou všechny známé chemické prvky uspořádány v horizontálních řadách nazývaných periody a vertikálních sloupcích nazývaných skupiny na základě jejich protonové číslo respektive atomová struktura.
Jedná se o uspořádání všech známých prvků, a proto poskytuje informace o prvcích, jako je jejich hmotnost, elektronové číslo, elektronová konfigurace a jejich jedinečné chemické vlastnosti.
Seznam prvků periodické tabulky
Zde je tabulka představující 118 prvků periodické tabulky. Uvedené prvky jsou uspořádány podle rostoucího pořadí atomového čísla a jejich příslušné atomové hmotnosti, symbolu, hustoty a elektronegativity.
| Prvky v periodické tabulce s atomovou hmotností | |||||
|---|---|---|---|---|---|
| Protonové číslo | Název chemického prvku | Symbol | atomová hmotnost (amu) | Hustota (g/cm 3 ) | Elektronegativita |
| 1 | Vodík | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | Hélium | On | 4,0026 | 0,0001785 | – |
| 3 | Lithium | Že | 6,941 | 0,534 | 0,98 |
| 4 | Berylium | Být | 9,0122 | 1,85 | 1,57 |
| 5 | Bor | B | 10,811 | 2.34 | 2.04 |
| 6 | Uhlík | C | 12.0107 | 2,267 | 2,55 |
| 7 | Dusík | N | 14,0067 | 0,0012506 | 3.04 |
| 8 | Kyslík | Ó | 15,9994 | 0,001429 | 3.44 |
| 9 | Fluor | F | 18,9984 | 0,001696 | 3,98 |
| 10 | Neon | Ano | 20,1797 | 0,0009002 | – |
| jedenáct | Sodík | Již | 22,9897 | 0,968 | 0,93 |
| 12 | Hořčík | Mg | 24,305 | 1,738 | 1.31 |
| 13 | Hliník | K | 26,9815 | 2.7 | 1.61 |
| 14 | Křemík | to jo | 28,0855 | 2,329 | 1.9 |
| patnáct | Fosfor | P | 30,9738 | 1,823 | 2.19 |
| 16 | Síra | S | 32 065 | 2.07 | 2.58 |
| 17 | Chlór | Cl | 35,453 | 0,0032 | 3.16 |
| 18 | Argon | S | 39,948 | 0,001784 | – |
| 19 | Draslík | K | 39,0983 | 0,89 | 0,82 |
| dvacet | Vápník | Že | 40 078 | 1,55 | 1 |
| dvacet jedna | Scandium | Sc | 44,9559 | 2,985 | 1.36 |
| 22 | Titan | Z | 47,867 | 4,506 | 1,54 |
| 23 | Vanadium | V | 50,9415 | 6.11 | 1,63 |
| 24 | Chrom | Cr | 51,9961 | 7.15 | 1,66 |
| 25 | Mangan | Mn | 54,938 | 7.21 | 1,55 |
| 26 | Žehlička | Víra | 55,845 | 7,874 | 1,83 |
| 27 | Kobalt | spol | 58,9332 | 8.9 | 1,88 |
| 28 | Nikl | v | 58,6934 | 8,908 | 1,91 |
| 29 | Měď | S | 63,546 | 1.9 | 60 |
| 30 | Zinek | Zn | 65,39 | 1,65 | 70 |
| 31 | Gallium | Tady | 69,723 | 1,81 | 19 |
| 32 | Germanium | Ge | 72,64 | 2.01 | 1.5 |
| 33 | Arsen | Tak jako | 74,9216 | 2.18 | 1.8 |
| 3. 4 | Selen | ON | 78,96 | 2,55 | 0,05 |
| 35 | Bróm | Br | 79,904 | 2,96 | 2.4 |
| 36 | Krypton | NOK | 83,798 | 3 | 1×10−4 |
| 37 | Rubidium | Rb | 85,4678 | 0,82 | 90 |
| 38 | Stroncium | Sr | 87,62 | 0,95 | 370 |
| 39 | Yttrium | A | 88,906 | 1.22 | 33 |
| 40 | Zirkonium | Zr | 91,224 | 1.33 | 165 |
| 41 | niob | Nb | 92,906 | 1.6 | dvacet |
| 42 | Molybden | Mo | 95,94 | 2.16 | 1.2 |
| 43 | Technecium | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Ruthenium | Ru | 101,07 | 2.2 | 0,001 |
| Čtyři pět | Rhodium | Rh | 102,91 | 2.28 | 0,001 |
| 46 | palladium | Pd | 106,42 | 2.2 | 0,015 |
| 47 | stříbrný | Na | 107,87 | 1,93 | 0,075 |
| 48 | Kadmium | CD | 112,411 | 1,69 | 0,159 |
| 49 | Indium | v | 114,82 | 1,78 | 0,25 |
| padesáti | Věřte | Sn | 118,71 | 1,96 | 23 |
| 51 | Antimon | Sb | 121,76 | 2.05 | 0,2 |
| 52 | Tellur | The | 127,6 | 2.1 | 0,001 |
| 53 | Jód | já | 126,9045 | 2.66 | 0,45 |
| 54 | Xenon | Auto | 131,293 | 2.6 | 3×10−5 |
| 55 | Cesium | Čs | 132,91 | 0,79 | 3 |
| 56 | Baryum | Ne | 137,327 | 0,89 | 425 |
| 57 | Lanthanum | The | 138,91 | 1.1 | 39 |
| 58 | Cerium | Tento | 140,12 | 1.12 | 66,5 |
| 59 | Praseodym | Pr | 140,9077 | 1.13 | 9.2 |
| 60 | Neodym | Nd | 144,24 | 1.14 | 41,5 |
| 61 | Promethium | Odpoledne | 145 | 1.13 | 2×10–19 |
| 62 | Samarium | Sm | 150,36 | 1.17 | 7.05 |
| 63 | europium | Eu | 151 964 | 1.2 | 2 |
| 64 | Gadolinium | Gd | 157,25 | 1.2 | 6.2 |
| 65 | Terbium | Tb | 158,9253 | 1.2 | 1.2 |
| 66 | Dysprosium | Tito | 162,5 | 1.22 | 5.2 |
| 67 | Holmium | Na | 164,9303 | 1.23 | 1.3 |
| 68 | Erbium | Je | 167,259 | 1.24 | 3.5 |
| 69 | Thulium | Tm | 168,9342 | 1.25 | 0,52 |
| 70 | Ytterbium | Yb | 173,04 | 1.1 | 3.2 |
| 71 | Paříž | Lu | 174 967 | 1.27 | 0,8 |
| 72 | Hafnium | Hf | 178,49 | 1.3 | 3 |
| 73 | Tantal | Tváří v tvář | 180,9479 | 1.5 | 2 |
| 74 | Wolfram | V | 183,84 | 2.36 | 1.3 |
| 75 | Rhenium | Re | 186,207 | 1.9 | 7×10−4 |
| 76 | Osmium | Vy | 190,23 | 2.2 | 0,002 |
| 77 | Iridium | A | 192,22 | 2.2 | 0,001 |
| 78 | Platina | Pt | 195,08 | 2.28 | 0,005 |
| 79 | Zlato | Na | 196,97 | 2.54 | 0,004 |
| 80 | Rtuť | Hg | 200,59 | 2 | 0,085 |
| 81 | Thallium | Tl | 204,3833 | 1,62 | 0,85 |
| 82 | Vést | Pb | 207,2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Vizmut | S | 208,9804 | 2.02 | 0,009 |
| 84 | Polonium | Po | 209 | 2 | 2×10–10 |
| 85 | Astatin | Na | 210 | 2.2 | 3×10–20 |
| 86 | Radon | Rn | 222 | 2.2 | 4×10–13 |
| 87 | Francium | Fr | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Rádium | slunce | 226 | 0,9 | 9×10−7 |
| 89 | Actinium | A | 227 | 1.1 | 5,5×10−10 |
| 90 | Thorium | Th | 232,0381 | 1.3 | 9.6 |
| 91 | Protaktinium | Studna | 231,0359 | 1.5 | 1,4×10−6 |
| 92 | Uran | V | 238,0289 | 1,38 | 2.7 |
| 93 | Neptune | Např | 237 | 1.36 | ≤ 3×10−12 |
| 94 | Plutonium | Mohl | 244 | 1.28 | ≤ 3×10−11 |
| 95 | Americium | Dopoledne | 243 | 1.13 | – |
| 96 | Curium | Cm | 247 | 1.28 | – |
| 97 | Berkelium | Bk | 247 | 1.3 | – |
| 98 | Kalifornie | Srov | 251 | 1.3 | – |
| 99 | Einsteinium | Je | 252 | 1.3 | – |
| 100 | Fermium | Fm | 257 | 1.3 | – |
| 101 | Mendělejev | Md | 258 | 1.3 | – |
| 102 | Ušlechtilý | Ne | 259 | 1.3 | – |
| 103 | Lawrencium | Lr | 262 | 1.3 | – |
| 104 | Rutherfordium | Rf | 267 | – | – |
| 105 | Dubnium | Db | 268 | – | – |
| 106 | Seaborgium | Sg | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hassium | Hs | 269 | – | – |
| 109 | Meitnerium | Mt | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Roentgenium | Rg | 282 | – | – |
| 112 | Koperník | Cn | 285 | – | – |
| 113 | Nihonium | Nh | 286 | – | – |
| 114 | Flerovium | v | 290 | – | – |
| 115 | Moskva | Mc | 290 | – | – |
| 116 | Livermorium | Lv | 293 | – | – |
| 117 | Tennessine | Ts | 294 | – | – |
| 118 | Oganessona | A | 294 | – | – |
Důležité pojmy v periodické tabulce
| Podmínky včetně programování c | Popis |
|---|---|
| Protonové číslo | Počet protonů, které tvoří jádro prvku, se nazývá jeho atomové číslo (Z). např. Uhlík pak obsahuje 6 protonů, takže jeho atomové číslo musí být pouze 6. |
| Atomová hmotnost | Je definována jako průměrná hmotnost atomů prvku. Měří se na základě relativního přirozeného zastoupení izotopů prvku. Atomová hmotnost se také nazývá atomová hmotnost (A). Měří se v jednotkách atomové hmotnosti (amu). |
| Doba | Vodorovné řádky zleva doprava v periodické tabulce se nazývají periody. V periodické tabulce je celkem 7 období. Prvky jsou uspořádány horizontálně kvůli jejich podobnostem ve vlastnostech, jako jsou stejné atomové orbitaly a tak dále. |
| Skupina | Svislé sloupce shora dolů v periodické tabulce se nazývají skupiny. V periodické tabulce je celkem 18 skupin. Prvky jsou uspořádány vertikálně kvůli jejich podobnosti ve vlastnostech, protože mají v sobě stejný počet valenčních elektronů. |
| Symbol prvku | Symbol je pojem, který se používá k reprezentaci chemického prvku pomocí písmene nebo kombinace dvou až tří písmen. např. Chemický symbol uhlíku je C, zatímco Fe se používá pro železo a tak dále. |
Klasifikace prvků v periodické tabulce
118 prvků je uspořádáno do 7 období a 18 skupin, jak je uvedeno výše. Dále jsou prvky rozděleny do různých bloků.
| Blok | Prvky v ceně | Poslední elektronová podslupka naplněna |
|---|---|---|
| s-blok | Skupina 1 (alkalické kovy) | s-subshell |
| Skupina 2 (kovy alkalických zemin) | ||
| p-blok | Skupina 13 (rodina Boronů) | p-subshell |
| Skupina 14 (Carbon Family) | ||
| Skupina 15 (rodina dusíku) | ||
| Skupina 16 (kyslíková rodina) | ||
| Skupina 17 (fluorová rodina) | ||
| d-blok | Skupiny 3 až 12 (přechodové prvky) | d-subshell |
| f-blok | Lanthanoidy (prvky vzácných zemin) | f-subshell |
| aktinidy |
Mendělejevova periodická tabulka
K reprezentaci podobností a trendů v chování prvků Mendělejev vyvinul periodickou tabulku, což je uspořádání prvků v rostoucí atomové hmotnosti v tabulkové formě.

Podle Mendělejevovy periodické tabulky byly prvky uspořádány podle jejich základní vlastnosti, atomové hmotnosti a chemických vlastností. V době Mendělejevovy práce bylo známo pouze 63 prvků. V Mendělejevově periodické tabulce byly vodorovné řady a svislé sloupce označovány jako skupiny a periody.
Mendělejevova periodická tabulka však selhává kvůli mnoha chybám v ní. Některé z nich jsou, že se nepodařilo určit vodík a vzácné plyny v něm. Také rostoucí pořadí atomové hmotnosti prvků nebylo v celé tabulce pravidelné. Dokonce i objev izotopů porušuje Mendělejevův periodický zákon.
Přečtěte si více:
- Moderní periodická tabulka
- Mendělejevova periodická tabulka
- Moderní periodický zákon
- Historie periodické tabulky
- Atomová struktura
Časté dotazy k periodické tabulce prvků
Co je periodická tabulka prvků?
Periodická tabulka prvků je tabulkové uspořádání chemických prvků organizovaných podle jejich atomového čísla, elektronové konfigurace a opakujících se chemických vlastností. Tabulka je rozdělena do řádků nazývaných období a sloupců nazývaných skupiny nebo rodiny.
Kdo objevil periodickou tabulku prvků?
Periodickou tabulku prvků neobjevil jediný člověk, ale za její vývoj se zasloužil ruský chemik Dmitri Mendělejev, který v roce 1869 uspořádal prvky na základě jejich vlastností.
Kdo vytvořil moderní periodickou tabulku?
V roce 1913 Henry Moseley představil aktualizovanou verzi periodické tabulky, běžně označované jako The Modern Periodic Table.
Jak je uspořádána periodická tabulka?
Periodická tabulka je uspořádána podle rostoucího atomového čísla, přičemž prvky jsou seskupeny na základě podobných chemických vlastností a jsou uspořádány do period (řádků) a skupin (sloupců).
Co je atomové číslo?
Počet protonů, které tvoří jádro prvku, se nazývá jeho atomové číslo (Z). např. Uhlík tedy obsahuje 6 protonů, jeho atomové číslo musí být pouze 6.
Mohou mít dva různé prvky stejné atomové číslo?
Počet neutronů v atomu ze dvou různých prvků může být podobný, ale počet protonů nebude nikdy stejný. Každý prvek má určitý počet protonů, který odpovídá počtu atomů.
Jak vypočítat atomovou hmotnost?
Atomovou hmotnost lze vypočítat přidáním hmotnosti protonů a neutronů v prvku.
Co je to skupina v periodické tabulce?
Sloupec v periodické tabulce odkazuje na skupinu periodické tabulky. Prvky stejné skupiny mají podobné fyzikální a chemické vlastnosti.
