Koncept hybridizace je definován jako proces spojení dvou atomových orbitalů za účelem vytvoření nového typu hybridizovaných orbitalů. Toto promísení obvykle vede k vytvoření hybridních orbitalů se zcela odlišnými energiemi, tvary a tak dále. Hybridizace je primárně prováděna atomovými orbitaly stejné energetické úrovně. Tohoto procesu se však mohou účastnit jak plně zaplněné, tak polozaplněné orbitaly, pokud jsou jejich energie stejné. Koncept hybridizace je rozšířením teorie valenčních vazeb, která nám pomáhá pochopit tvorbu vazeb, energie vazeb a délky vazeb.
návrhové vzory v jazyce Java
Co je hybridizace?
Když se dva atomové orbitaly spojí a vytvoří hybridní orbital v molekule, energie orbitalů jednotlivých atomů se přerozdělí tak, aby vznikly orbitaly ekvivalentní energie. Toto je známé jako hybridizace.
Atomové orbitaly srovnatelných energií se smíchají během hybridizačního procesu, který většinou zahrnuje sloučení dvou orbitalů nebo dvou orbitalů „p“ nebo smíchání orbitalu „s“ s orbitalem „p“ a také „s“ orbital s 'd' orbitalem.
Hybridní orbitaly jsou nové orbitaly vzniklé jako výsledek tohoto procesu. Ještě důležitější je, že hybridní orbitaly mohou být použity k vysvětlení vlastností atomových vazeb a molekulární geometrie. Uhlík například tvoří čtyři jednoduché vazby, ve kterých se slučuje orbital valenčního pláště s se třemi orbitaly valenčního pláště p. Tato kombinace generuje čtyři ekvivalentní sp3směsi. Ty budou uspořádány do čtyřstěnu kolem uhlíku, který je vázán na čtyři různé atomy.
Kroky k určení typu hybridizace
Pro pochopení typu hybridizace v atomu nebo iontu je třeba dodržovat následující pravidla.
- Nejprve určete celkový počet valenčních elektronů obsažených v atomu nebo iontu.
- Poté spočítejte počet osamocených párů připojených k tomuto atomu nebo iontu.
- Nyní lze počet požadovaných orbitalů vypočítat přidáním počtu duplexů nebo oktetů a počtu osamělých párů elektronů.
- Je třeba poznamenat, že geometrie orbitalů v atomech nebo iontech je odlišná, když neexistuje žádný osamocený pár elektronů.
Vlastnosti hybridizace
- Hybridizace probíhá mezi atomovými orbitaly se stejnými energiemi.
- Počet vytvořených hybridních orbitalů se rovná počtu atomových orbitalů, které se mísí.
- Není nutné, aby se hybridizace účastnily všechny zpola zaplněné orbitaly. Účastnit se mohou i orbitaly, které jsou zcela naplněny, ale mají mírně proměnlivou energii.
- K hybridizaci dochází pouze při tvorbě vazby, nikoli v jediném atomu plynu.
- Pokud je známa hybridizace molekuly, lze předpovědět tvar molekuly.
- Větší lalok hybridního orbitalu je vždy kladný, zatímco menší lalok na opačné straně je vždy záporný.
Typy hybridizace
Hybridizaci lze klasifikovat jako sp3, sp2, sp., sp3d, sp3d2, nebo sp3d3na základě typů orbitalů zapojených do míchání.
sp Hybridizace
Nastává, když se jeden orbital s a jeden p v hlavním obalu atomu spojí a vytvoří dva nové ekvivalentní orbitaly. Nově vzniklé orbitaly jsou známé jako sp hybridizované orbitaly. Vytváří lineární molekuly pod úhlem 180°. Znamená to kombinaci jednoho orbitalu a jednoho orbitalu „p“ o stejné energii k vytvoření nového hybridního orbitalu známého jako sp hybridizovaný orbital.
- Je také známá jako diagonální hybridizace.
- Každý sp hybridizovaný orbital obsahuje stejné množství znaků s a p.
- Všechny sloučeniny berylia, jako je BeF2, Studna2a BeCl2, jsou příklady.

sp2Hybridizace
Nastává, když se jeden s a dva orbitaly p v obalu stejného atomu spojí a vytvoří tři ekvivalentní orbitaly. Nově vzniklé orbitaly jsou známé jako sp2hybridní orbitaly. Je také známá jako trigonální hybridizace. Znamená to zkombinovat svůj orbital se dvěma „p“ orbitaly stejné energie, aby se vytvořil nový hybridní orbital známý jako sp.2. Trigonální symetrická směs orbitalů s a p je udržována na 120 stupních. Všechny tři hybridní orbitaly zůstávají ve stejné rovině a svírají mezi sebou úhel 120°.
- Každý vytvořený hybridní orbital má 33,33 % a 66,66 % „p“ charakter.
- Molekuly s trojúhelníkovým rovinným tvarem mají centrální atom, který je spojen se třemi dalšími atomy a je sp2hybridizované. Příklady jsou sloučeniny boru.
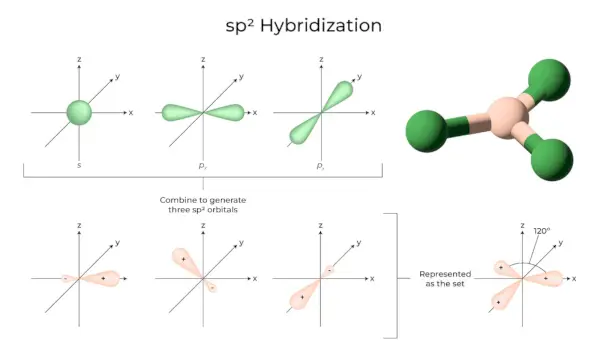
sp3Hybridizace
Když se jeden orbital „s“ a tři orbitaly „p“ ze stejného obalu atomu spojí a vytvoří čtyři nové ekvivalentní orbitaly, hybridizace je známá jako tetraedrická hybridizace nebo sp.3. Nově vzniklé orbitaly jsou známé jako sp3hybridní orbitaly. Ty jsou zaměřeny na čtyři rohy pravidelného čtyřstěnu a tvoří spolu úhel 109°28′.
- Sp3hybridní orbitaly svírají úhel 109,28 stupně.
- Každý hybridní orbital má 25 % s charakter a 75 % p charakter.
- Ethan a metan jsou dva příklady.
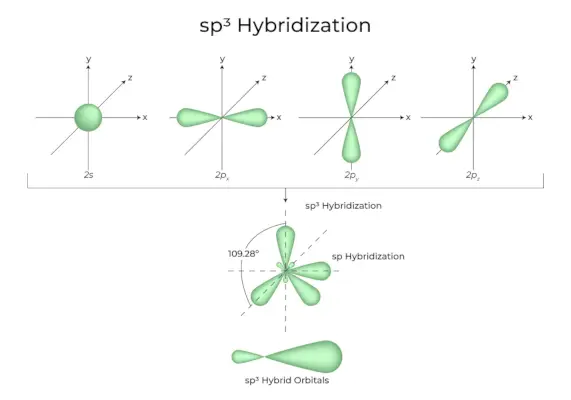
sp3d Hybridizace
Smícháním 1s orbitalů, 3p orbitalů a 1d orbitalů vznikne 5 sp3d hybridizovaných orbitalů stejné energie. Jejich geometrie je trigonální bipyramidová. Kombinace orbitalů s, p a d vede k trigonální bipyramidové symetrii. Rovníkové orbitaly jsou tři hybridní orbitaly, které jsou vůči sobě orientovány pod úhlem 120° a leží v horizontální rovině.
- Zbývající dva orbitaly, známé jako axiální orbitaly, jsou ve vertikální rovině v rovině 90 stupňů rovníkových orbitalů.
- Hybridizace v chloridu fosforečném, například (PCl5).
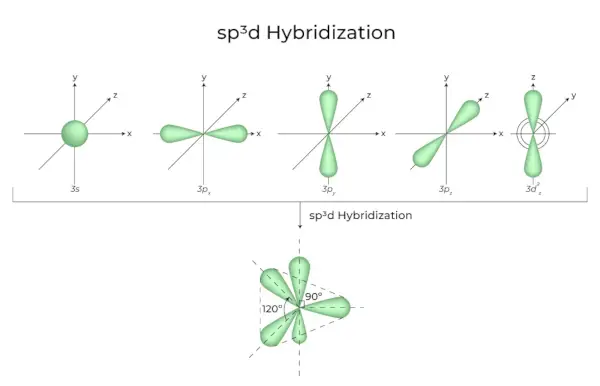
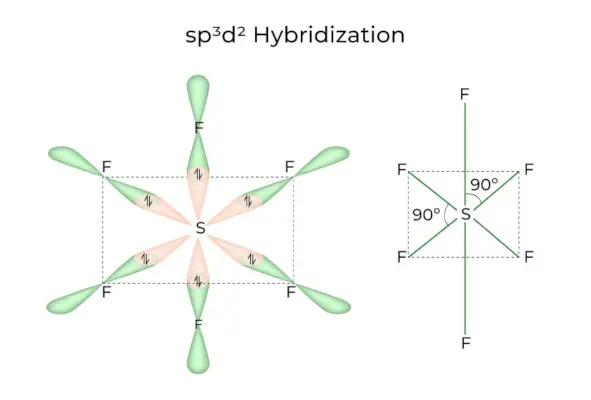
sp3d2 Hybridizace
Když se orbitaly 1s, 3p a 2d spojí a vytvoří 6 identických sp3d2hybridní orbitaly, hybridizace se nazývá sp3d2Hybridizace. Těchto sedm orbitalů ukazuje na rohy osmistěnu. Jsou vůči sobě nakloněny v úhlu 90 stupňů.
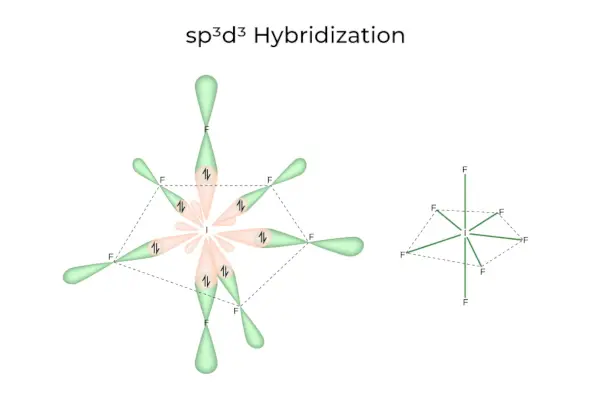
sp3d3Hybridizace
Má 1s, 3p a 3d orbitaly, které se spojí a vytvoří 7 identických sp3d3hybridní orbitaly. Těchto sedm orbitalů ukazuje na rohy pětiúhelníkového bipyramidu. např. LI6.
Tvary hybridizace
- Lineární: Sp hybridizace je způsobena interakcí dvouelektronových skupin; orbitální úhel je 180°. Trigonální rovina: Jsou zapojeny tři skupiny elektronů, což má za následek sp2hybridizace; orbitaly jsou od sebe 120°. Tetraedrální: Jsou zapojeny čtyři elektronové skupiny, což má za následek sp3hybridizace; orbitální úhel je 109,5°. Trigonální bipyramidové: Je zapojeno pět elektronových skupin, což má za následek sp3d hybridizace; orbitální úhly jsou 90° a 120°. Oktaedrální: Je zapojeno šest elektronových skupin, což má za následek sp3d2hybridizace; orbitaly jsou od sebe 90°.
Časté dotazy na Hybridizace
Otázka 1: Který hybridní orbital mezi sp, sp2 a sp3 je elektronegativnější?
Odpovědět:
Procento charakteru s v sp, sp2, a sp3hybridizovaného uhlíku je 50 %, 33,33 % a 25 %. Vzhledem ke kulovitému tvaru orbitalu s je přitahován jádrem rovnoměrně ze všech směrů. Výsledkem je, že hybridní orbital s charakterem S bude blíže k jádru a tím pádem více elektronegativní. V důsledku toho je sp hybridizovaný uhlík nejvíce elektronegativní.
Otázka 2: Co jsou hybridní orbitaly?
Odpovědět:
Hybridní orbitaly vznikají spojením standardních atomových orbitalů a výsledkem je vytvoření nových atomových orbitalů.
Otázka 3: Jakých je pět tvarů hybridizace?
Odpovědět:
Lineární, trigonální rovinný, tetraedrický, trigonální bipyramidový a oktaedrický je pět základních tvarů hybridizace.
Otázka 4: Proč molekula amidu vypadá jako sp3hybridizovaný, ale je sp2?
Odpovědět:
Pokud je atom buď uzavřen dvěma nebo více orbitaly p nebo má osamocený pár schopný skočit do orbitalu p, obecný proces hybridizace se změní. Výsledkem je, že v případě amidové molekuly vstoupí osamocený pár do orbitalu p, což má za následek tři sousední paralelní orbitaly p.
Otázka 5: Co je Bentovo pravidlo?
síť a internet
Odpovědět:
Centrální atom spojený s četnými skupinami v molekule bude hybridizovat, což způsobí, že orbitaly s charakterem více s budou nasměrovány k elektropozitivním skupinám a orbitaly s charakterem p budou nasměrovány k elektronegativním skupinám.
